Pengertian, Perkembangan dan Ragam Penemu
Teori Atom
Asal Usul Teori Atom
Dalam catatan sejarah, Teori Atom termasuk salah satu teori tertua yang muncul dan ditemukan di dunia. Teori ini kemudian dikembangkan menjadi lebih kompleks dan menjadi salah satu dasar pengetahuan yang cukup penting, terutama dalam sains. Menurut sejarah yang tercatat, penemu Teori Atom adalah seorang yang berasal dari Yunani, yakni Democritus.
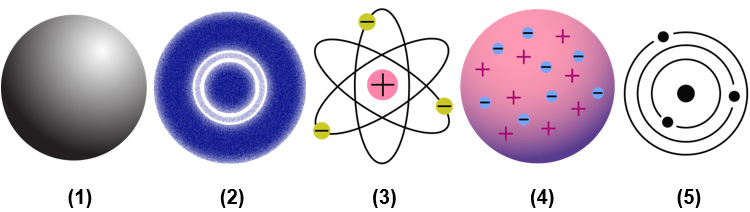
Democritus merupakan tokoh ulung terkait Teori Atom. Ia merupakan seseorang yang pertama kali menemukan teori ini pada awal abad ke-5 sebelum masehi. Dalam hal ini, Democritus mengemukakan bahwa benda-benda yang ada bisa dibagi menjadi beberapa atau banyak bagian yang sangat kecil.
Bagian-bagian benda tersebut akhirnya tidak akan bisa dibagi lagi. Bagian inilah yang kemudian oleh Democritus disebut sebagai atom. Menurutnya, atom sepenuhnya padat, tidak terdapat struktur internal serta ada ruang kosong antar atom guna memberikan ruang untuk pergerakannya. Ia mencontohkan dengan pergerakan dalam air dan udara.
Selain itu, dalam penjelasan mengenai Teori Atom yang ia temukan, Democritus mengatakan bahwa ada perbedaan sifat dari material yang berbeda, atom memiliki perbedaan dan dibedakan dalam beberapa bentuk, massa serta ukurannya. Berdasarkan pada model atom yang ia buat, Democritus mampu menjelaskan jika memang atom-lah yang menyusun benda-benda.
Perkembangan Teori Atom
Seiring waktu berjalan, Teori Atom juga mengalami beberapa perkembangan yang cukup signifikan. Hal ini dikarenakan teori yang lama akan menyempurnakan teori sebelumnya. Salah satu fakta yang tercatat dalam penemuan teori ini oleh Democritus adalah ia kurang memiliki bukti eksperimental sehingga teorinya dianggap kurang sempurna.
Akhirnya, pada medio tahun 1800 mulai ditemukan beberapa penemuan baru terkait Teori Atom yang kehadirannya memberikan pengertian dan pemahaman yang luas mengenai apa itu atom. Pada masanya, terdapat beberapa perkembangan terkait teori ini yang datang dari beberapa tokoh yang berbeda.
1. Teori Atom Dalton
Perkembangan mengenai Teori Atom diawali oleh John Dalton. Ia mengemukakan pendapat awalnya mengenai atom pada tahun 1803. Dalam hal ini, teori yang dikemukakan oleh Dalton didasarkan pada dua hukum, yaitu hukum kekekalan massa atau hukum Lavoisier dan hukum susunan tetap atau hukum Proust.
Dalam penjelasannya, Lavoisier mengatakan bahwa massa total dari zat-zat sebelum reaksi akan selalu sama dengan massa total dari zat-zat yang dihasilkan dari reaksi. Sedangkan Proust mengatakan bahwa perbandingan massa pada unsur-unsur dalam suatu senyawa senantiasa akan selalu tetap.
Dari kedua hukum tersebut, John Dalton mengemukakan pendapatnya terkait Teori Atom sebagai berikut:
- Atom merupakan bagian terkecil dari sebuah materi dan karena ukurannya yang paling kecil sehingga tidak bisa lagi dibagi menjadi bagian lain.
- Atom digambarkan dengan bola pejal yang sangat kecil dengan kesimpulan bahwa suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda pula.
- Atom-atom bergabung untuk membentuk sebuah senyawa dengan perbandingan bilangan bulat serta sederhana. Dalam hal ini dimisalkan air yang terdiri dari atom-atom hidrogen dan atom-atom oksigen.
- Reaksi kimia merupakan pemisahan dan juga penggabungan atau penyusunan kembali dari rangkai atom-atom sehingga atom tidak akan bisa diciptakan atau dimusnahkan.
Pendapat dari Dalton ini menjadi awal dari perkembangan Teori Atom dalam dunia pengetahuan. Kemunculan teori Dalton ini juga memberikan beberapa kelebihan dalam pengetahuan yakni mulai membangkitkan minat terkait penelitian mengenai beragam jenis modal atom.
Akan tetapi, Teori Atom yang dikemukakan oleh Dalton masih memiliki beberapa kelemahan. Adapun beberapa kelemahan dari teori Dalton adalah sebagai berikut:
- Tidak dapat menjelaskan bagaimana cara atom tersebut saling berkaitan
- Tidak dapat menjelaskan hubungan antara larutan senyawa dengan daya hantar sebuah arus listrik karena atom merupakan bagian terkecil unsur atau benda yang tidak bisa dibagi lagi
- Tidak dapat menjelaskan sifat listrik materi
- Tidak bisa menjelaskan perbedaan antara atom unsur yang satu dengan atom unsur lainnya.
2. Teori Atom Thomson
Tahapan perkembangan Teori Atom selanjutnya adalah teori yang dikemukakan oleh Thomson. Teori ini muncul setelah teori Dalton. Dalam perkembangannya, Thomson melakukan perbaikan terkait kelemahan yang terdapat dalam teori yang dikemukakan oleh Dalton yang merupakan penemu pertama teori modern yang membahas tentang atom.
Dalam hal ini, perbaikan terkait Teori Atom yang dikemukakan oleh Dalton adalah dengan penemuan elektron oleh Thomson pada tahun 1897. Dalam hal ini, elektron merupakan partikel yang bermuatan negatif.
Penemuan yang dilakukan oleh Thomson ini diperoleh melalui sebuah percobaan dengan menggunakan tabung sinar katode. Berdasarkan percobaan tersebut, Thomson menyimpulkan bahwa sinar katode adalah sebuah partikel dikarenakan dapat memutar baling-baling yang diletakkan diantara anode dan katode.
Partikel tersebut merupakan partikel penyusun atom yang bermuatan negatif. Nah, inilah yang nantinya dalam Teori Atom versi Thomson disebut dengan elektron.
Isi dari Teori Atom yang dikemukakan oleh Thomson adalah atom merupakan sebuah bola pejal yang memiliki muatan positif. Selain itu, di dalamnya tersebar elektron yang memiliki muatan negatif. Teori yang dikemukakan oleh Thomson ini juga disebut dengan teori roti kismis. Hal ini dikarenakan kismis mewakili atom positif yang melekat pada roti sebagai elektron negatif.
Rincian Teori Atom yang dikemukakan oleh Thomson memiliki beberapa kelebihan dibandingkan dengan teori Dalton. Beberapa kelebihan dari teori ini adalah sebagai berikut:
- Detail Teori Atom dari Thomson membuktikan bahwa atom bukan merupakan bagian terkecil dari suatu unsur. Hal ini dikarenakan Thomson menemukan adanya partikel lain yang bermuatan negatif dan terdapat pada atom.
- Membuktikan bahwa atom bersifat netral yang tersusun dari partikel-partikel yang memiliki muatan positif dan negatif.
- Membuktikan bahwa adanya elektron dalam semua unsur benda.
Namun, Teori Atom yang dikemukakan oleh Thomson tersebut masih memiliki beberapa kekurangan. Adapun kekurangan dari teori ini adalah sebagai berikut:
- Tidak dapat menjelaskan tentang susunan muatan positif dan jumlah elektron yang terdapat dalam bola
- Tidak dapat menjelaskan tentang inti dari atom.
3. Teori Atom Rutherford
Perkembangan selanjutnya terkait Teori Atom adalah teori yang dikemukakan oleh Rutherford. Teori ini didasarkan pada eksperimen dengan melakukan penembakan partikel alfa terhadap lempeng emas. Eksperimen tersebut kemudian dikenal dengan eksperimen Geiger-Marsden.
Nama dari eksperimen tersebut merupakan murid dari Rutherford. Pada waktu itu, ia bersama kedua muridnya tersebut melakukan percobaan dengan menembakkan partikel atau sinar alfa terhadap lempeng tipis emas. Partikel alfa sendiri merupakan partikel yang memiliki muatan positif, bergerak lurus serta memiliki daya tembus yang besar.
Dari percobaan yang dilakukan tersebut, sinar alfa ada yang dibelokkan, dipantulkan dan diteruskan. Percobaan yang dilakukan tersebut sebenarnya ditujukan untuk membuktikan kebenaran Teori Atom Thomson di mana atom merupakan sebuah bola pejal yang bermuatan positif dan jika dikenai partikel alfa akan dipantulkan atau dibelokkan.
Hasil yang didapatkan dari percobaan tersebut kemudian dikembangkan menjadi sebuah hipotesis Teori Atom Rutherford yang menyatakan beberapa hal, diantaranya adalah sebagai berikut:
- Elektron yang memiliki muatan negatif bergerak mengelilingi inti atom yang bermuatan positif dengan kecepatan yang sangat tinggi
- Atom memiliki inti atom yang bermuatan positif dan menjadi pusat massa atom
- Penyebaran partikel alfa tidak dipengaruhi oleh adanya awan elektron
- Sebagian besar dari atom merupakan permukaan yang kosong atau hampa
- Sebagian kecil dari partikel alfa yang lewat akan dibelokkan dan sedikit sekali yang dipantulkan sedangkan sebagian besar lainnya tidak mengalami hambatan.
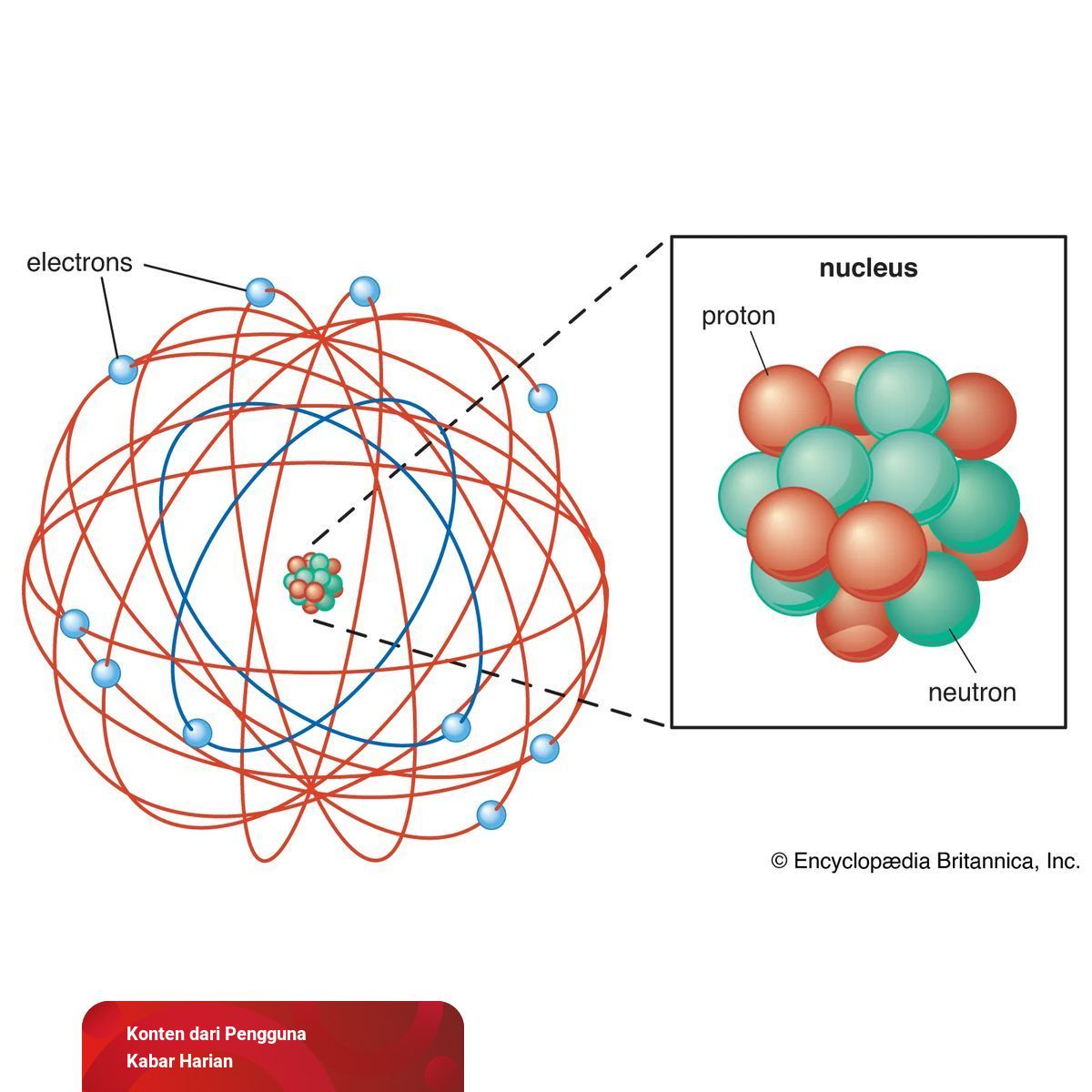
Pada tahun 1922, berdasarkan eksperimen yang dilakukan sebelumnya, Rutherford menyangkal Teori Atom yang dikemukakan oleh Thomson. Ia mengatakan bahwa atom memiliki inti yang merupakan pusat massa dan diberi nama nukleus yang dikelilingi oleh awan elektron yang bermuatan negatif.
Pernyataan ini kemudian dinamakan dengan Teori Atom Rutherford. Dalam perkembangannya, teori ini memiliki beberapa kelebihan, yaitu:
- Dapat menggambarkan serta menjelaskan bentuk lintasan elektron yang mengelilingi inti dari atom sehingga mudah dipahami
- Dapat memberikan kesimpulan bahwa atom tersusun dari inti serta elektron yang mengelilingi di mana satu sama lain terpisah oleh ruang hampa
- Dapat menjelaskan pergerakan elektron di sekitar atom.
Akan tetapi, Teori Atom yang dikemukakan oleh Rutherford tersebut masih memiliki beberapa kekurangan. Beberapa diantaranya adalah sebagai berikut:
- Tidak mampu menjelaskan kenapa elektron tidak pernah jatuh ke dalam inti atom sesuai dengan teori fisika klasik
- Tidak mampu menjelaskan terkait spektrum garis pada atom hidrogen
- Tidak mampu menjelaskan letak dari elektron dan cara rotasinya terkait inti atom
- Elektron yang bergerak akan memancarkan energi sehingga secara keseluruhan energi atom tidak stabil.
4. Teori Atom Bohr
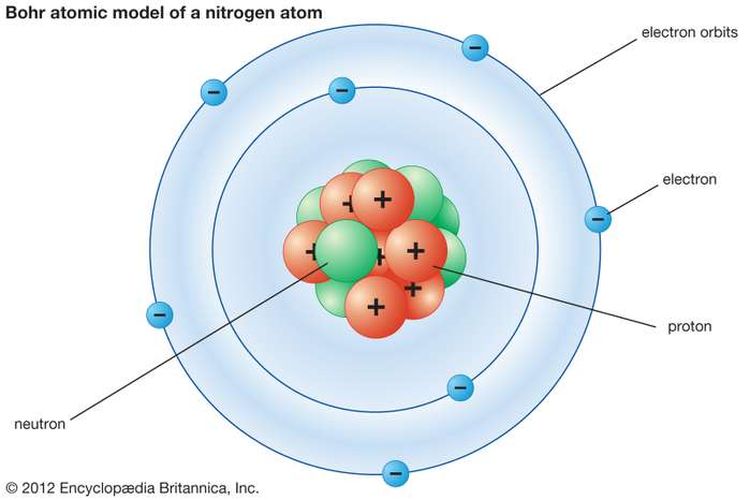
Sekitar tahun 1913, seorang pakar fisika dari Denmark, yaitu Bohr melakukan eksperimen yang kemudian dikenal dengan nama spektrum atom hidrogen. Eksperimen yang dilakukan tersebut bertujuan untuk menyempurnakan capaian dalam Teori Atom Rutherford yang sudah muncul sebelumnya. Eksperimen ini berhasil menggambarkan keadaan elektron.
Penjelasan yang diberikan oleh Bohr mengenai atom hidrogen adalah gabungan dari teori klasik yang berasal dari Teori Atom Rutherford dan teori kuantum yang dijelaskan oleh Planck. Adapun hipotesis dari Bohr terkait hasil eksperimen yang dilakukan adalah sebagai berikut:
- Elektron dapat berpindah dari orbit satu ke orbit yang lain dengan dasar tingkatan energi. Elektron akan berpindah menuju ke orbit yang memiliki energi lebih tinggi jika elektron menyerap energi yang memiliki besaran sama dengan perbedaan energi antara dua orbit yang bersangkutan.
Sebaliknya, elektron yang berpindah ke orbit yang memiliki energi lebih rendah akan memancarkan radiasi yang teramati sebagai spektrum garis yang besarnya sama dengan perbedaan energi antara kedua orbit yang bersangkutan.
- Elektron akan berada dalam keadaan stationer dan tidak memancarkan energi selama dalam orbitnya.
- Jika elektron berpindah dan menempati orbit yang lebih tinggi, maka atom dalam molekul berada dalam tingkat tereksitasi.
- Jika elektron berpindah dan menempati orbit yang lebih rendah, maka atom dan molekul berada dalam tingkat dasar.
- Elektron mengelilingi inti atom dalam orbit tertentu yang berbentuk lingkaran dan disebut dengan kulit elektron di mana dinyatakan dalam bentuk notasi K, L, M, N dan seterusnya.
- Energi yang dimiliki elektron pada masing-masing orbit dapat mempengaruhi besar kecil lingkaran orbit.
Dalam hal ini, Teori Atom Bohr digambarkan seperti sebuah tata surya mini. Berdasarkan teori ini, maka elektron mengelilingi atom pada lintasan tertentu yang dinamakan dengan kulit elektron. Teori yang dikemukakan oleh Bohr ini memiliki beberapa kelebihan, yaitu:
- Dapat menjelaskan tentang spektrum atom hidrogen secara akurat
- Dapat membuktikan adanya lintasan elektron untuk atom hidrogen
- Dapat memperbaiki kelemahan dari Teori Atom yang dikemukakan oleh Rutherford.
Akan tetapi, Teori Atom yang dikemukakan oleh Bohr masih memiliki beberapa kekurangan. Adapun beberapa kekurangan yang dimaksud adalah sebagai berikut:
- Tidak banyak menjelaskan tentang spektrum warna dari atom yang memiliki banyak elektron atau yang lebih kompleks
- Tidak dapat menjelaskan tentang adanya garis halus dalam spektrum hidrogen karena elektron dianggap sebagai partikel
- Model atom Bohr memiliki nilai momentum sudut lintasan ground state yang salah
- Tidak bisa mengetahui intensitas relatif dari garis spektrum
- Tidak bisa menjelaskan atom selain atom hidrogen.
Teori Atom modern
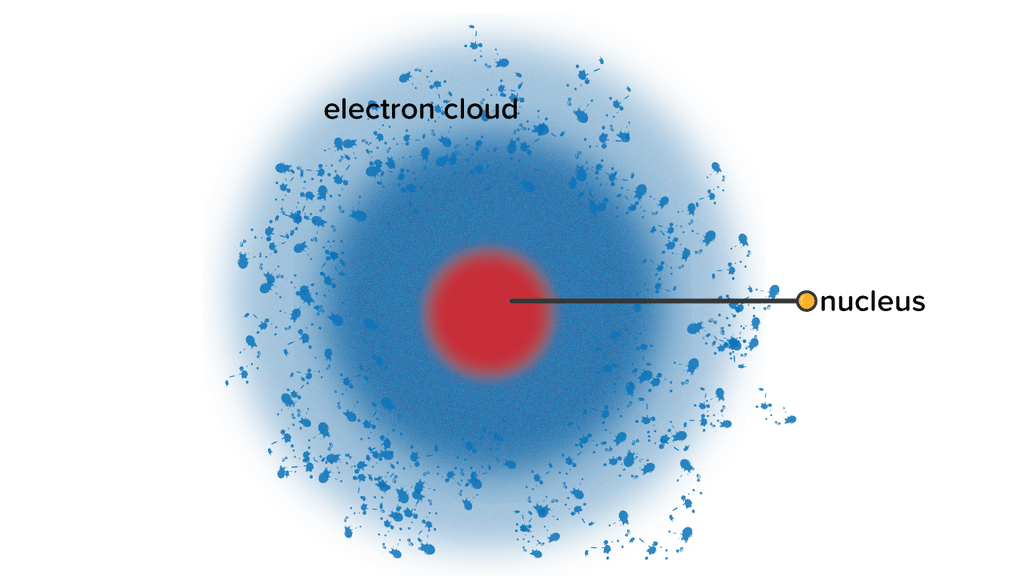
Teori Atom berkembang lagi pada tahun 1924. Dalam hal ini ada tokoh Perancis bernama Louis de Broglie yang menyempurnakan kelemahan Teori Atom yang dikemukakan oleh Bohr. Ia menjelaskan bahwa elektron tidak hanya bersifat partikel, namun juga bisa bersifat gelombang.
Pendapat ini kemudian dikembangkan lagi oleh Edwin dan Werner dan melahirkan Teori Atom modern. Teori ini juga disebut dengan nama Teori Atom Mekanika Kuantum. Dasar dari teori ini adalah gerakan elektron dalam mengelilingi inti bersifat layaknya sebuah gelombang. Hingga saat ini, teori ini merupakan teori paling mutakhir terkait atom.
Demikian beberapa penjelasan mengenai kemunculan dan perkembangan dari Teori Atom. Teori ini merupakan salah satu yang paling penting dalam hal pemahaman mengenai benda-benda terkait ilmu fisika dan kimia. Semoga bermanfaat.
clik here for next informationn about Perkembangan Model Atom or play video below this






1 Komentar
cakeppp
BalasHapus